Stelara ist ein Medikament zur Behandlung von Schuppenflechte und Psoriasis arthritis. Der Wirkstoff darin heißt Ustekinumab. Weitere Medikamente mit dem Wirkstoff heißen Absimky, Eksunbi, Fymskina, Imuldosa, Otulfi, Pyzchiva, Steqeyma und Uzpruvo.
Diese Medikamente sind rezeptpflichtig.
Stelara gehört zur Gruppe der so genannten Biologika. Diese Stoffe heißen so, weil sie von lebenden Zellen hergestellt werden – mit „Bio“ wie man es vom Lebensmittelmarkt kennt hat das nichts zu tun. Bei Ustekinumab handelt es sich um einen gentechnisch hergestellten humanen Antikörper gegen bestimmte entzündliche Botenstoffe (die Zytokine Interleukin-12 und Interleukin-23). Ustekinumab gibt es als Spritze in zwei verschiedenen Dosierungen für die subkutane Anwendung – also zum Spritzen unter die Haut.
Stelara ist seit Januar 2009 in der EU zugelassen.
Uzpruvo wurde im Januar 2024 zugelassen. Es ist ein sogenanntes Biosimilar – ein "Nachbau" von Stelara. Pyzchiva erhielt die Zulassung im April 2024. Eksunbi, Fymskina und Otulfi kamen im Juli 2024 hinzu.
Bei welcher Erkrankung wird Ustekinumab angewandt?
Ustekinumab kann bei erwachsenen Patienten mit mittelschwerer bis schwerer chronischer Plaque-Psoriasis angewandt werden, wenn andere innerlich angewandte Therapien einschließlich Ciclosporin, Methotrexat oder PUVA nicht genügend gewirkt haben, kontraindiziert sind oder nicht vertragen werden.
Heranwachsende ab 6 Jahren können Stelara bekommen, wenn ihre Schuppenflechte mit anderen innerlichen Therapien oder einer Lichttherapie nicht in den Griff zu bekommen ist – oder wenn sie diese Therapien nicht vertragen.
Außerdem kann es bei Erwachsenen mit Psoriasis arthritis eingesetzt werden – dann allein oder in Kombination mit Methotrexat, wenn so genannte DMARDs nicht ausreichend wirken. Für die Anwendung bei Psoriasis arthritis hatte der Hersteller vor allem die Ergebnisse aus zwei groß angelegten Studien angeführt. Darin waren die Wirksamkeit und die Sicherheit von Stelara untersucht worden, wenn eine Dosis von 45 oder 90 Milligramm zu Beginn, nach vier und dann alle zwölf Wochen gegeben wurde. Die Studien trugen den Titel PSUMMIT I und II.
Andere Krankheiten, mit denen Stelara behandelt werden kann, sind Morbus Crohn und Colitis ulcerosa.
Wirkmechanismus
Die körpereigenen Zytokine Interleukin-12 (Il-12) und Interleukin- 3 (Il-23) sind an der Aktivierung von Immunzellen beteiligt, die bei der Entstehung und Aufrechterhaltung der Psoriasis von Bedeutung sind. Ustekinumab ist ein humaner monoklonaler Antikörper, der hoch spezifisch an eine Untereinheit dieser Zytokine bindet und dadurch die Bindung an ihre Andockstellen auf der Oberfläche der Immunzellen verhindert. Die Kaskade von Entzündungsreaktionen wird dadurch unterbrochen.
Wie wird Ustekinumab angewandt?
Es wird empfohlen, dass die Behandlung mit Stelara von speziellen Fachärzten eingeleitet und überwacht wird, die über viel Erfahrung mit der Psoriasis-Behandlung mit Biologika verfügen.
Die Therapie wird bei erwachsenen Patienten mit Plaque-Psoriasis mit einer Injektion von 45 mg unter die Haut (subkutan) begonnen. Eine weitere Dosis von 45 mg erfolgt nach vier Wochen und anschließend alle 12 Wochen als Erhaltungstherapie. Bei Patienten mit einem Körpergewicht über 100 kg kann alternativ auch eine Dosis von 90 mg eingesetzt werden. Bei Patienten die nach einer Behandlungsdauer von bis zu 28 Wochen keine wesentliche Besserung zeigen, sollte ein Absetzen der Therapie erwogen werden.
Ustekinumab wird als subkutane Injektion im Bereich der Vorderseite der Oberschenkels, des Bauches (mindestens 5 cm entfernt vom Bauchnabel) oder an der Außenfläche der Oberarme verabreicht. Die Injektionsstelle sollte möglichst frei von Psoriasis-Herden sein.
Wann darf das Medikament nicht angewandt werden?
- bei bekannter Überempfindlichkeit gegen den Wirkstoff oder einen der anderen Inhaltsstoffe
- bei aktiven schweren Infektionen
- bei aktiver Tuberkulose
Worauf müssen Arzt und Betroffener besonders achten?
Mit Ustekinumab wurde ein neuer Weg in der Behandlung der Psoriasis beschritten. Die Wirksamkeit und Sicherheit war zum Zeitpunkt der Zulassung nur bis zu einem Zeitraum von drei Jahren untersucht – über mögliche Langzeitfolgen der Behandlung kann daher noch keine Aussage gemacht werden. Darüber muss der Arzt Sie vor der Behandlung aufklären und ihr schriftliches Einverständnis einholen.
Ustekinumab unterdrückt das körpereigene Immunsystem und kann daher unter Umständen das Infektionsrisiko erhöhen bzw. latent vorhandene Infektionen wieder aufflackern lassen. Bei klinisch bedeutsamen, aktiven Infektionen darf der Wirkstoff daher nicht verabreicht werden. Auch bei einer bekannten Neigung zu immer wieder auftretenden Infektionen ist Vorsicht geboten.
Besonders gefürchtet ist unter der Behandlung mit Stelara das Wiederaufflackern einer nicht richtig ausgeheilten Tuberkulose (TBC). Ihr Arzt wird Sie daher ausführlich befragen, ob Sie jemals an einer TBC erkrankt waren oder Kontakt mit TBC-Kranken hatten. Zusätzlich wird unter Umständen mittels Röntgenaufnahme und/oder Hauttest (Tuberkulin-Test) nach einer inaktiven (latenten) Tuberkulose gefahndet.
Wird eine aktive Tuberkulose festgestellt, darf mit der Therapie mit Stelara nicht begonnen werden. Bei einer inaktiven Tuberkulose wird zuerst eine Anti-Tuberkulosetherapie eingeleitet.
Auch wenn sich vor der Therapie keine Hinweise für eine Tuberkulose ergeben haben, ist eine spätere Infektion oder ein Wiederaufflackern nicht völlig ausgeschlossen. Sie sollten daher während des Behandlungszeitraums besonders auf mögliche Anzeichen einer Tuberkulose wie anhaltender Husten, Gewichtsverlust, niedriges Fieber und Nachtschweiß achten und ggf. sofort Ihren Arzt informieren.
Auch andere Infektionen können unter Ustekinumab gehäuft auftreten bzw. schwerer verlaufen. Ihr Arzt wird daher versuchen, Infektionen vor der Behandlung weitgehend auszuschließen. Tritt eine schwere Infektion während der Behandlung auf, muss die Behandlung mit Ustekinumab möglicherweise abgebrochen werden, bis die Infektion unter Kontrolle ist.
Beim heutigen Wissenstand kann nicht ganz ausgeschlossen werden, dass Ustekinumab durch die Unterdrückung des Immunsystems auch das Risiko für bösartige Erkrankungen erhöht. Es bestehen keine Erfahrungen bei Patienten mit einem bösartigen Tumor in der Vorgeschichte oder bei einem Auftreten solch eines Tumors während der Behandlung. In diesen Fällen ist besondere Vorsicht geboten.
Manche Impfstoffe enthalten lebende Erreger. Auf Impfungen mit solchen Lebend-Impfstoffen sollte während und bis zu 15 Wochen nach der Therapie mit Ustekinumab verzichtet werden. Dazu gehören z.B. Impfungen gegen TBC, Masern, Mumps, Röteln, Windpocken, Gelbfieber und Typhus. Es wurde bisher nicht untersucht, ob auch die Impfantwort auf andere Impfstoffe beeinflusst wird. Empfohlene Standardimpfungen sollten daher möglichst vor der Behandlung mit Ustekinumab vorgenommen werden.
In einem Fall kam es während der Behandlung mit Stelara zu einem „Reversiblen posterioren Leukoenzephalopathie Syndrom (RPLS). Der Patient hatte 12 Dosen Ustekinumab über einen Zeitraum von etwa zwei Jahren erhalten und erkrankte mit Kopfschmerzen, Krampfanfällen und Verwirrung. Nach Absetzen von Ustekinumab und geeigneter Behandlung erholte er sich vollständig. Wenn Symptome auf solche eine Erkrankung hinweisen, sollte Ustekinumab abgesetzt werden.
Bei einer schweren allergischen Reaktion muss die Behandlung ebenfalls sofort abgesetzt werden. Der Nadelschutz der Fertigspritze enthält Latex, das auch zu allergischen Reaktionen führen kann.
Eine übermäßige Sonnenbestrahlung sollte während der Therapie mit Stelara vermieden werden. Empfohlen werden die üblichen Methoden zum Sonnenschutz einschließlich Sonnencreme.
Ustekinumab in Schwangerschaft und Stillzeit
Da nicht genug Erfahrungen in Schwangerschaft und Stillzeit vorliegen, sollte Stelara hier nicht bzw. nur nach strenger Risikoabwägung eingesetzt werden. Während und bis zu 15 Wochen nach der Behandlung ist eine sichere Empfängnisverhütung zu empfehlen.
Mögliche Nebenwirkungen von Ustekinumab
Sehr häufig (bei mehr als 1 Behandelten von 10)
- Infektionen der oberen Atemwege (17%), Schnupfen und Racheninfekte (21,5%)
Häufig (bei 1 bis 10 Behandelten von 100)
- Depressionen
- Halsschmerzen, verstopfte Nase
- Durchfall
- Juckreiz
- Rückenschmerzen, Muskelschmerzen
- Erschöpfung
- Rötung an der Injektionsstelle
Gelegentlich (1 bis 10 Behandelte von 1.000)
- Reaktionen an der Injektionsstelle (u.a. Schmerzen, Schwellung, Juckreiz, Verhärtung, Blutung, Bluterguss und Irritation.
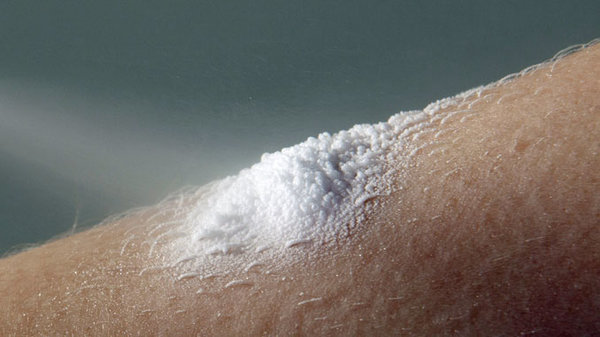
- Nicht entzündliche Exfoliation der Haut: Bei ersten Anzeichen einer großflächigen Pellung der Haut sollen Patienten sofort zum Arzt zu gehen. (siehe dazu gesonderten Artikel)
Selten (1 bis 10 Behandelte von 10.000)
- Exfoliative Dermatitis (Erythrodermie): Bei ersten Anzeichen einer großflächiger Entzündung + großflächigen Pellung der Haut sollen Patienten sofort zum Arzt zu gehen. (siehe dazu gesonderten Artikel)
Einzelfälle
- Nicht-infektiöse Lungenentzündung (Pneunomie): Es wurden vereinzelt Fälle schwerwiegender chronisch-entzündlicher Lungenerkrankungen gemeldet. Diese "arzneimittelinduzierte interstitielle Lungenkrankheit verläuft oft unerkannt, weil sie nur schwer diagnostizierbar ist." Bei ersten Anzeichen von Atemnot und nicht verschwindendem, starkem Husten sollen Patienten sofort zum Arzt zu gehen.
In einer Studie vier Jahre nach Zulassung von Stelara wurde neben der Wirkung des Medikamentes auch auf seine Sicherheit geschaut (siehe Quelle [1]). Dabei stellten sich keine anderen Nebenwirkungen oder Probleme heraus als vorher schon bekannt. Die bekannten aber sind dadurch natürlich nicht weniger gravierend.
Ausgewertet wurden die Daten von 1.700 Patienten, die an vier verschiedenen Studien teilgenommen hatten. Die am häufigsten gemeldeten Nebenwirkungen, medizinisch korrekt "unerwünschte Ereignisse" genannt, waren
- Entzündung des Nasenrachsens (Nasopharyngitis)
- Infektionen der oberen Atemwege
- Gelenkschmerzen (Arthralgie)
- Nebenhöhlenentzündung (Sinusitis)
- Kopf- und Rückenschmerzen sowie
- Grippe (Influenza)
Beobachtet wurden aber auch
- schwere Infektionen
- Heller Hautkrebs (nicht-melanozytäre Hauttumore)
- andere Krebs-Arten (Malignome) und die
- schwere Herz-"Ereignisse" wie Herzinfarkt, Schlaganfall oder Herztod (Major Adverse Cardiac Event = MACE)
Die Zahl der Krebs-Fälle (ohne hellen Hautkrebs) war nicht höher als im US-Durchschnitt zu erwarten war.
Die Zahl der Herzinfarkte oder Schlaganfälle, die nicht tödlich endeten, entsprach der von Psoriasis-Patienten allgemein.
Am 21. November 2014 gab der Hersteller von Stelara einen so genannten „Rote-Hand-Brief“ für die Ärzte heraus. Während der Behandlung mit dem Biologikum kann in seltenen Fällen eine exfoliative Dermatitis (Erythrodermie) auftreten. Auch eine nicht entzündliche Exfoliation der Haut wurde gelegentlich bei Psoriasis-Patienten während der Ustekinumab-Behandlung beobachtet. Bei einer exfoliativen Dermatitis rötet sich die Haut auf mehr als 90 Prozent der Oberfläche, sie "pellt" sich ab. Aber: Auch die Psoriasis an sich kann plötzlich "explodieren" – sich über den ganzen Körper ausbreiten und zu einer Erythrodermie werden. Beides äußert sich als schwere, großflächige Entzündung auf der Haut. Das Problem: Die Symptome sind äußerlich nicht zu unterscheiden.
Die Entzündung war oft mit Fieber verbunden. Wenn das nicht möglichst frühzeitig mit Kortison behandelt wird, kann es zu Infektionen, Nährstoffverlusten und Flüssigkeitsmangel kommen.
Die exfoliative Dermatitis ist eine ernsthafte Erkrankung, die jedoch relativ selten auftritt. Einige dieser Stelara-Patienten mussten im Krankenhaus behandelt werden. Der Hersteller Janssen-Cilag gibt an, bei Stelara sei das Risiko „selten“ – das heißt, 0,01 Prozent bis maximal 0,1 Prozent der Patienten müssten damit rechnen. Die nicht entzündliche Exfoliation der Haut käme dagegen schon „gelegentlich“ vor – das heißt in 0,1 Prozent bis höchstens 1 Prozent der Fälle.
Bei ersten Anzeichen einer großflächiger Entzündung und / oder einer großflächigen Pellung der Haut sollten Patienten sofort zum Arzt zu gehen und sich behandeln zu lassen – auch ohne Termin.
Wechselwirkungen mit anderen Medikamenten oder Wirkstoffen
Es wurden mit Ustekinumab keine speziellen Studien zur Verträglichkeit zusammen mit anderen Medikamenten durchgeführt. Besondere Vorsicht ist bei Kombination mit Wirkstoffen geboten, die ebenfalls das Abwehrsystem beeinträchtigen. Dies gilt vor allem für Ciclosporin, das wie Ustekinumab die Zytokine Il-12 und Il-23 hemmt.
Daten aus Studien
An einer Studie in Phase III - also gar nicht mehr weit vor der Zulassung - hatten 1.230 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis teilgenommen.
Die Studienteilnehmer bekamen am Anfang und vier Wochen später eine Spritze unter die Haut. Danach wurde Ustekinumab nur noch alls zwölf Wochen gespritzt. Die einen nahmen eine Dosis von 45 Milligramm, die anderen von 90 Milligramm.
Bei der niedrigeren Dosis besserte sich die Psoriasis bei 67 Prozent der Betroffenen um 75 Prozent und mehr, gemessen nach zwölf Wochen.
Bei der höheren Dosis besserte sich die Psoriasis bei 76 Prozent der Betroffenen um 90 Prozent und mehr, ebenfalls gemessen nach zwölf Wochen.
Verglichen wurde auch die Lebensqualität (Dermatology Life Quality Index = DLQI) der Psoriasis-Kranken vor, während und nach einer Behandlung. Nach zwölf Wochen Behandlung mit Ustekinumab gab mehr als ein Drittel der Patienten keine Beeinträchtigung ihres Lebens durch die Psoriasis oder die Therapie mehr an.
Quellen:
- Ärzte Zeitung, 05.10.2007
- Finanztreff, 04.10.2007
- Unternehmensangaben, 03.10.2007
Was sollte man sonst noch wissen?
Etwa 5 Prozent der Patienten entwickeln während der Behandlung Antikörper gegen Ustekinumab. Tendenziell war die Wirksamkeit bei diesen Patienten etwas geringer ausgeprägt – das Vorhandensein von Antikörpern schließt das Ansprechen auf Ustekinumab aber nicht aus.
Die Biologika Infliximab und Ustekinumab sind aufgrund ihres schnellen Wirkeintritts auch für schwere Formen der Psoriasis und kritische Situationen geeignet, bei denen ein schnelles Ansprechen erforderlich ist. In den Studien mit Ustekinumab zeigte sich schon nach zwei Wochen bei vielen Patienten eine deutliche Besserung. Bis zur 24. Behandlungswoche sprachen in den Studien 76% der Patienten unter der Dosierung von 45 mg und 85% unter einer Therapie mit 90 mg an.
 Wer Stelara bekommt, kann vom Arzt eine Broschüre bekommen. Sie ist kein Ersatz für den gesetzlich vorgeschriebenen Beipackzettel (Gebrauchsinformation), sondern eine vereinfachte, besser verständliche Form. Die Broschüre unterscheidet sich von anderen, weil sie selbst auf dem Titelblatt keine Fotos "glücklicher Menschen" enthält. Damit entspricht sie äußerlich dem, was wir von einer seriösen Patienteninformation über eine ernsthafte Krankheit erwarten.
Wer Stelara bekommt, kann vom Arzt eine Broschüre bekommen. Sie ist kein Ersatz für den gesetzlich vorgeschriebenen Beipackzettel (Gebrauchsinformation), sondern eine vereinfachte, besser verständliche Form. Die Broschüre unterscheidet sich von anderen, weil sie selbst auf dem Titelblatt keine Fotos "glücklicher Menschen" enthält. Damit entspricht sie äußerlich dem, was wir von einer seriösen Patienteninformation über eine ernsthafte Krankheit erwarten.
Man kann sie nicht selbst anfordern. Das muss der Arzt machen. Für die Bestellung braucht der Arzt diese Nummer: Mat.-Nr.: 100110717
Lagerung von Ustekinumab
Die Fertigspritzen müssen im Kühlschrank (2-8°C) aufbewahrt werden. Um den Inhalt vor Licht zu schützen, sollte man die Spritzen in der Originalverpackung lassen. Die Spritzen dürfen nicht eingefroren und nicht geschüttelt werden.
Maria Weiß, Ärztin
Kosten
Eine Packung mit einer Stelara-Spritze oder einem Stelara-Pen kostet 5818,60 Euro (Stand 04.01.2024). Dabei ist es egal, ob 45 oder 90 mg Ustekinumab enthalten sind. Das ist ein Listenpreis. Er kann durch Verträge zwischen Hersteller und Krankenkasse anders sein und dient nur als ungefähre Angabe.
Stelara ist damit im Laufe der letzten Jarhe teurer geworden: Im Juni 2020 wurde noch ein Preis von 5186,62 Euro aufgerufen.
Den Preis von Uzpruvo tragen wir nach, sobald er bekannt ist.
In der Leitlinie zur Therapie der Psoriasis vulgaris (Stand 2017) werden insgesamt Kosten von 25.107,05 Euro für das erste Jahr der Behandlung angegeben.
Verwendete Literatur:
- Fachinformation Stelara
- Frank Bachmann et al; Stellenwert der Biologika im Praxisalltag; AP Dermatologie/Allergologie 2009; 4: 28-31
Zum Weiterlesen
- Ustekinumab und Secukinumab: In Studien wirksamer als in Realität (Deutsche Apotheker-Zeitung, Februar 2021)
- Stelara schneidet besser ab als Enbrel
- Forum: Erfahrungen mit Stelara bzw. Ustekinumab
Der Hersteller von Stelara bietet eine Informationsmappe mit Broschüren. Außerdem enthält die Mappe einen "Psoriasis Pass": Das ist zum einen eine Scheckkarte, die man bei sich tragen kann. Daraus geht hervor, dass man mit dem Wirkstoff Ustekinumab behandelt wird. Zum anderen gehört dazu ein Heft, in dem man praktischerweise wesentliche Daten für den Arztbesuch dokumentieren kann. Die Informationsmappe kann vom Arzt beim Hersteller bestellt werden. Dafür benötigt der Arzt diese Nummer: Mat.-Nr.: 100111539.
Kurz gemeldet
- Dezember 2024: Die südkoreanische Firma Dong-A ST hat die Zulassung für sein Ustekinumab-Biosimilar Imuldosa erhalten. [Quelle]
- April 2024: Ein weiteres Biosimilar mit dem Wirkstoff Ustekinumab sollte zugelassen werden, meint das Expertengremium der europäischen Zulassungsbehörde. Es wird Wezenla heißen. [Quelle]
- Februar 2024: Die Expertenrunde bei der europäischen Behörde für Arzneimittel hat ein weiteres Biosimilar empfohlen: Pyzchiva. Hersteller ist Samsung Bioepis. [Quelle]
- Januar 2024: Die Europäische Kommission hat das Biosimilar Uzpruvo zugelassen. Damit ist das erste Biosimilar mit dem Wirkstoff Ustekinumab in Deutschland und Europa offziell da. [Quelle]
- Januar 2024: Die US-Arzneimittelbehörde FDA hat einen Zulassungsantrag für ein weiteres Biosimilar mit Ustekinumab angenommen. Das meldet der Hersteller Accord BioPharma. Sein Biosimilar trägt das Kürzel DMB-3115. [Quelle]
- Dezember 2023: Weil zunehmend Generika (genauer: Biosimilar) für seinen wichtigsten Kassenschlager auf den Markt kommen, rechnet der Stelara-Hersteller Johnson & Johnson in den USA mit weniger Wachstum. "Die Arznei hatte dem Pharma- und Medizintechnikhersteller im vergangenen Jahr gut 9,7 Milliarden Dollar in die Kassen gespült." [Quelle]
- November 2023: Die Expertenrunde bei der europäischen Behörde für Arzneimittel hat empfohlen, dass ein Biosimilar mit dem Wirkstoff Ustekinumab zugelassen wird. Es heißt Uzpruvo. Hersteller ist die Stada Arzneimittel AG. [Quelle]
- November 2023: In den USA wurde ein Biosimilar für / mit dem Wirkstoff Ustekinumab zugelassen. Es heißt Wezlana. Hersteller ist die Firma Amgen. [Quelle]
- November 2020: Auch bei Stelara bzw. dem Wirkstoff Ustekinumab läuft einmal der Patentschutz ab. Ein Kandidat für einen Nachbau ist FYB202. Eine Studie in Phase III ist startklar. Hersteller sind die Firmen Formycon und Bioeq. [Quelle]
- Juni 2020: Stelara hat in einer Studie zur Behandlung vom Systemischen Lupus erythematodes nicht ausreichend gewirkt. Deshalb wird es für diese Erkrankung nicht weiterentwickelt. [Quelle: Hersteller]
- Dezember 2019: Der entsprechende Ausschuss hat empfohlen, dass Stelara bei Kindern ab 6 Jahren für die Behandlung der Schuppenflechte eingesetzt werden kann. Bislang liegt die untere Altersgrenze bei 12 Jahren. [Quelle]
- September 2019: Stelara kann nun auch bei Erwachsenen mit mittelschwerer bis schwerer Colitis ulcerosa eingesetzt werden. [Quelle]
- Oktober 2018: Bei Patienten, die nicht gut auf Stelara angesprochen hatten, wurde die Schuppenflechte bei einer Umstellung auf Kyntheum (Wirkstoff: Brodalumab) besser. (Quelle: Studie im British Journal of Dermatology)
- Oktober 2018: Stelara wirkt bei einem Systemischen Lupus erythematodes (SLE). In einer Studie mit 102 Patienten war die Krankheit nach einem Jahr bei denen, die Ustekinumab bekommen hatten, nicht mehr so aktiv. (Quelle: Hersteller)
- Juni 2017: Wird eine Schuppenflechte nach 16 Wochen mit Stelara nicht deutlich besser, könnte es helfen, die Behandlung zu wechseln – auf Tremfya (Wirkstoff Guselkumab). (Quelle: Studie im British Journal of Dermatology)
Quelle [1]
- Reich, Leonardi, Griffiths et al.: "Ergebnisse des klinischen Entwicklungsprogramms mit bis zu vier Jahren Nachkontrolle", 22. Weltkongress der Dermatologen, 22.-29. Mai 2011) Seoul, Korea
- Angaben des Herstellers


Empfohlene Kommentare
Keine Kommentare vorhanden
Erstelle ein Benutzerkonto oder melde dich an, um zu kommentieren
Du musst ein Benutzerkonto haben, um einen Kommentar verfassen zu können
Benutzerkonto erstellen
Neues Benutzerkonto für unsere Community erstellen. Es ist einfach!
Neues Benutzerkonto erstellenAnmelden
Du hast bereits ein Benutzerkonto? Melde dich hier an.
Jetzt anmelden